私は、医歯薬学の分野で博士号を取得後、ポスドクを経て、現在は企業で薬理研究に従事しております。10年ほど研究を行い、多くの先輩方の教えや自分なりの試行錯誤もあり、自分なりの研究スタイルが確立してきたと思います。
そんな時、下記の悩みを持つ学生さんとお話ししたことがあります。

実験を頑張っているものの、あまり研究が進まず、自分は研究者に向いていなんじゃないかと落ち込んでいます。
どうやったら効率的に実験成果を挙げることができるのでしょうか?

私も同じ悩みを持っていました。
そこで、私が先生や先輩から教わってきた研究の進め方を4つご紹介し、参考にしてみてください!
具体的な実験方法を教わることはあっても、研究の進め方について教わる機会が少ない方もいらっしゃると思い、本記事では、『効率的な研究の進め方4つ』をご紹介します。
仮説を明確にしてから実験する
そもそも仮説とは?
仮説(かせつ、英: hypothesis)とは、真偽はともかくとして、何らかの現象や法則性を説明するのに役立つ命題のこと。
Wikioedia
では、以下の二つの仮説のうち、どちらの仮説の方が真実に近づきやすい仮説だと思いますか?
- この実験を行えば、因子Xのタンパク質量に変化が見られのではないか?
- この実験を行えば、因子Xのタンパク質量が減少するのではないか?
答えは2番です。明確なスタンスを取ることが仮説を立てる、ということです。
一つ目の仮説では、タンパク質量が増えても減っても、後から理由付けし、次の実験に移行するまでに時間を要してしまいます。一方、二つ目の仮説では、データが出た時に、仮説に合致するデータなのか?仮説に反する結果なのか?をすぐに判断でき、次の実験に移行することができます。
仮説を仮のFigureにしてから実験を行う
仮説を明確にした次のステップとして、仮説を仮Figure化することが重要です。
例えば、
- ウエスタンブロッティングの泳動順とバンドの発現パターン
- フローサイトメーターのプロットの位置 (対照群と処置群の変化)
- PCRの発現量比較の棒グラフ
- 増殖曲線の折れ線グラフ
が仮説の仮Figure化になります。
具体的な仮Figure化の一例を以下に示します。
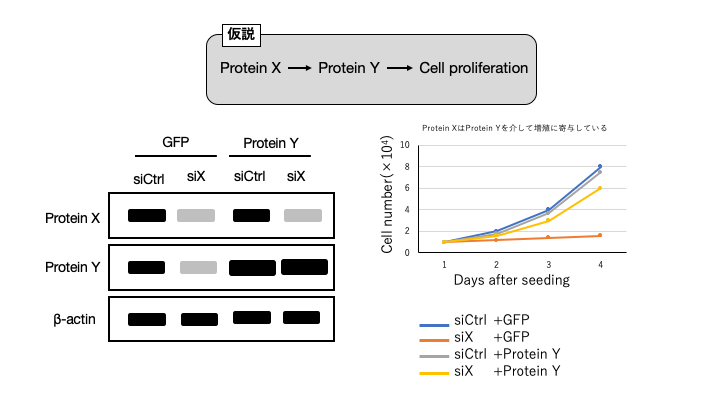
例えば、Protein X が Protein Y を介して増殖に関与していることを証明したいとき、どのようなFigureが必要かを視覚化します。
siRNA を用いて Protein X をノックダウンする操作と高発現ベクターを用いた Protein Y の高発現 (コントロールとして GFP 発現) する操作を用いるとします。その場合、左側のウェスタンブロッティングの図と右側の増殖の折れ線グラフを用いることで、証明したい仮説を証明しうる結果を仮Figure化します。
このFigure化することのメリットとして、以下のような点が挙げられます。
- 仮のグラフに数値を入れることで、どのぐらいの精度の実験が必要か?を理解できる。
- 仮説を可視化してディスカッションすることで、指導教官との認識のズレを減らすことができる。
- どの数値とどの数値を比較するればいいのか?を明確にすることができる。
- 仮説を実験に落とし込むことで、どうやってデータを取得するか? (今の実験設備で証明可能か?それとも共同研究や新たな大型機器の導入が必要か?) を明確にできる。
- (ウエスタンの場合) 電気泳動の際にサンプルを流す順番を明確にできる。
このように、仮説の仮Figure化は、仮説を人間(自分と他人)が認識できるように可視化することに役立ちます。また、仮説の可視化により、具体性のある議論・結果の予測・実験の仕込みが可能になります。
仮説を立てる注意事項
ここで一つ注意なのですが、仮説は仮説であって、「答えありき」ではありません。
仮説に沿って実験を行い、
→仮説通りの時は本当のデータを当てはめる。
→仮説通りでなかったときは、実験方法を変更することで仮説を証明する余地があるのか?それとも、その結果をもとに新たな仮説を立てるのか判断することになります。
京都大学名誉教授・元総長である井村裕夫先生がロマンチックな科学者―世界に輝く日本の生物科学者たちにて、以下のように述べられています。
もちろんセオリーを作ることは時として問題もある。それはセオリーに固執し、その奴隷になることがあるからである。こうなると、実験をして結果がセオリーに合わないと、それを棄ててしまったりすることになる。(中略)。セオリーは最初はあくまでも、いつでも棄てられる作業仮説でなければならない。
ロマンチックな科学者―世界に輝く日本の生物科学者たち, 井川洋二, 羊土社, page 186(ファクトとセオリー 研究の進め方をめぐって 井村裕夫)
ここでのセオリーとは、仮説によって論理的に導き出された一般的原理を指すと考えられます。
初めに立てた仮説に固執しすぎに柔軟に対応していきましょう。
本実験と予備検討を同時に行う
「本実験と同時に小さな予備検討を行うことで、予備検討の時間を削減でき、トータルで研究のスピードが上がる」と昔の所属ラボの教授よりアドバイスをもらい、今でも実践している実験の進め方になります。
そもそも、予備検討とは?
- 自分が検証したい仮説を証明するための実験=本実験
- 本実験を行うために最適な実験条件を決めるための予備的な実験=予備検討
例えば、培養細胞株に阻害剤を添加する実験を行う場合を考えてみます。
その際、以下のような疑問が生まれると思います。
- 阻害剤の添加濃度は?
- 阻害剤を添加するタイミングは?
- 細胞に阻害剤を作用させる時間は何時間?
- 阻害剤を作用させすぎて細胞が死んでしまわないか?
- 目的のタンパク質を阻害できているかを確認する手法は?
過去の文献を読むことで、上記のいくつかはある程度決めることができると思います。しかし、文献に詳しく書いてないこともあるため、実際の自分の実験環境に合わせた条件を設定する必要があります。
このように、特定のタンパク質を阻害するという実験ですが、多くの要素が関わるので、本番の実験を行う前に、新しく採用する実験方法が適切に実施できるかを予備的に検討することが必要になります。
常に本実験を行える体制を作る
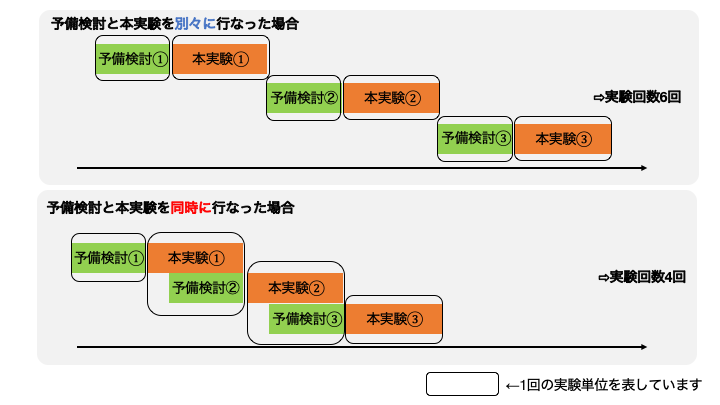
本実験と予備検討を同時に行うということは、以下の概念図のように実験を行うことです。本実験と次の実験の予備検討を同時に行うことで、予備検討にかける時間を減らします。
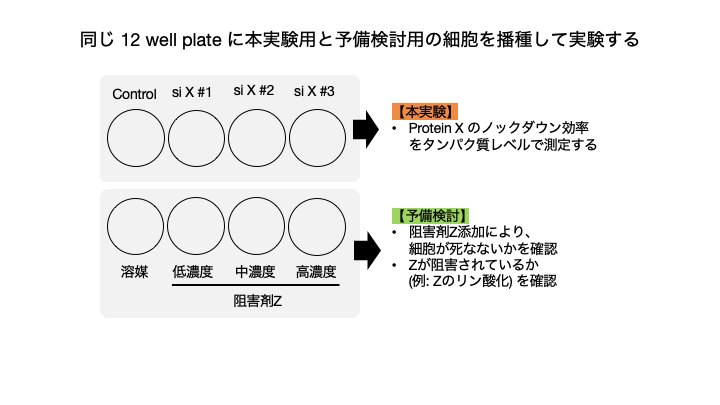
では、どのように本実験と予備実験を同時に行うのか?具体的な方法をお伝えします。
下記の図にあるように、本実験の目的はsiRNAを用いて Protein X のノックダウン効率を測定することとします。その際、12 well plate の余りの well に細胞を播種し、次の実験で使用する予定の阻害剤の濃度を振って、阻害剤による細胞死が誘導されないか?目的のタンパク質が阻害されているかの予備検討を行います。
このように、本実験と予備検討をそれぞれ単体に実験をするのではなく、本実験のついでにできる次の実験の予備検討を仕込むことが、研究スピードアップにつながります。
一つの実験のかたまりから、1.5個分のデータを出すイメージです。
しかし、予備検討に気を取られて、本実験の結果が得られないのは本末転倒になります。本実験に支障がない程度に、予備検討を実験に組み込んでください。あくまでも本実験達成が目的であり、予備検討は “ついで” であることを認識して、実験を行うことにしましょう!
実験ノートに貼る用のプロトコールを印刷する

実験ノートを書く重要性はわかっていますが、実験時は適当な記載にして、後でまとめて記載する、という状況になっています…

実験ノートは、自分のデータの正確性を担保するために非常に重要です。
テンプレートを活用して、ルーティーンで記入する内容は事前に紙に印刷しておきましょう!
具体的なプロトコールのテンプレートを教えます!

具体的にどんなプロトコールを作ればいいの?
例えばウエスタンブロッティングを行うとします。
その際、全てのプロトコールをノートに自分の字で記入していては、書くことが面倒になり、現実的に全てをかき切ることが難しいと思います。
そこで、下記のような手順書をWordファイルで作成することをお勧めします。
| 実験手順 | 実施欄 |
| (1) SDS 電気泳動ゲル ( %ゲル) にタンパク質をロードし、電気泳動泳動する (時間 : ~ : )。 | |
| (2) メンブレンに転写する ( V)(時間 : ~ : ) | |
| (3) メンブレンをブロッキング・バッファー (バッファーの組成 ) にひたす(時間 : ~ : ) 。 | |
| (4) 一次抗体(抗体名: , 商品番号: , 希釈倍率: ) (時間 : ~ : ) 。 | |
| (5) TBST洗浄(洗浄回数:□, □, □, □ ←洗浄液を交換したらチェックを入れる) (時間 : ~ : ) | |
| (6) 二次抗体反応(抗体名: , 商品番号: , 希釈倍率: ) (時間 : ~ : ) 。 | |
| (7) TBST洗浄(洗浄回数:□, □, □, □ ←洗浄液を交換したらチェックを入れる) (時間 : ~ : ) | |
| (8) メンブレンを検出試薬と反応させる(A液 μL, B液 μL)。 | |
| (9) 余分な検出試薬を取り除き、メンブレンをガラス板で挟み、LAS 4000にてシグナルを検出する。 |
研究室の実験ノートして、コクヨ 研究記録用ノート リサーチラボノートエントリーモデル A4もしくはスタンダード A4
を実験ノートとして用いている研究室が多いのではないでしょうか?
A4のノートに手順書をすぐに貼り付けられるように、上記の手順書をB5の紙に複数枚コピー&ペーストして、印刷し、ハサミで切って短冊状にすることで、実験するときは、この紙を実験ノートに貼ることで、プロトコールテンプレートができ、実験ノート作成の手間を削減することができます。
ルーティーンで回す実験手法は5つ程度だと思いますので、よく使う実験手法で、この手順書を作ることでノート作成の手間を軽減することができます。
実験ノートに貼る用のプロトコールを作成するメリット
- ルーティーンの操作を手書きする手間が減るので、気づいたことや変更点などを正確に実験ノートに記入することができる。
- 記入すべき内容 (使用した試薬の商品番号やロット、反応時間・温度など) を空欄にしておくことで、記入漏れを減らすことができる。
- 記録時間を節約できるので、目の前の現象に注目することができ、大事な現象の見逃しを減らすことができる。
注意点としては、実施に実施しなかった実験方法に関しては斜線を引くなどして、実施していない旨を明確にしましょう。
実験ごとに実験番号を振り、実験ごとに管理する

みなさんは、どのように実験結果を保存・管理していますか?
私は、実験ごとに「実験番号」をふり、その実験番号フォルダの中に、実験の計画書・実験結果の生データ・Excelでの統計解析結果・イラストレーターで編集した画像・考察を記入したパワーポイントなど、その実験に関係するものを、一つのフォルダの中に格納しています。
例えば、Protein Xの機能解析として、Protein Xが高発現している膵がんと膠芽腫(悪性脳腫瘍の一種)の研究、発生期において高発現していることからProtein X のノックアウトマウスを用いた発生学的な研究を行なっていると仮定します。
その場合、
| 実験番号例 | |
| 膵がん(Pancreatic ductal adenocarcinoma: PDA)の研究テーマ | PDA-01, 02, 03… |
| 膠芽腫 (Glioblastoma Multiforme: GBM) の研究テーマ | GBM-01, 02, 03.. |
| 発生学(Developmental bioleogy)的なテーマ | DEV-01, 02, 03… |
と、実験テーマごとに実験番号の頭文字(PDA, GBM, DEV)を決めます。

次に、一つの実験ごとにPDA-01, PDA-02…と実験順に実験番号を振っていきます。その際、簡単な実験内容について記入しておきます。
例えば、PDA-01の場合、「膵癌の細胞株PANC1細胞における、siRNAを用いた Protein ノックダウン効率を測定した実験」を意味します。
このようにすることで、時系列で実験を管理することができ、タイトルを見ることで、自分がどんな実験を行ったのかを後から見返した時、すぐに理解することができます。
このように、実験結果、実験の方法、考察に実験番号を振ることで、後から実験番号を頼りに自分のPC内を検索して、目的のものを見つけ出しやすくなるというメリットもあります。
まとめ
ここまで私の実験や研究の進め方について書いてきました。
研究者それぞれが、自分の実験の進め方を持っていると思います。そこで、これを機にあなたにとって身近な先生・ポスドク・博士課程の学生に、研究の進め方についてヒアリングしてみてはいかかでしょうか?
新たな学びがあるかもしれません!!
また、まだまだ私も効率的に実験を行える方法について勉強中なので、本ブログを読んだ方で「こんなふうに実験を行うと効率的!」というものがあれば、twitterのリプライやDM、本ブログへのコメントで教えてください!



コメント